
|
|
|||||
|
||||||
2017藥審報告發布:50品種優先審評上市摘要:
醫藥網3月26日訊 2017年,國家食品藥品監督管理總局(以下簡稱總局)認真貫徹中共中央辦公廳、國務院辦公廳《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》(廳字〔2017〕42號,以下簡稱42號文件)和國務院《關于改革藥品醫療器械審評審批制度的意見》(國發〔2015〕44號,以下簡稱44號文件)文件精神,以保證藥品有效安全、滿足公眾臨床用藥需求為工作目標,在鼓勵藥物研發創新、提高藥品質量方面開展了一系列工作,不斷推進審評審批制度改革,堅持依法依規、科學規范審評,切實保護和促進公眾健康。
一、藥品注冊申請審評審批完成情況
(一)審評審批總體完成情況
1.批準上市藥品情況
2017年,總局批準上市藥品394個(以藥品批準文號計),其中化學藥品369個,中藥民族藥(以下簡稱中藥)2個,生物制品23個;國產藥品278個,進口藥品116個;國產藥品中化學新藥28個,中藥新藥1個,生物制品10個,化學仿制藥238個,中藥仿制藥1個;納入優先審評審批品種53個,占13.5%。
2.全年審評審批完成情況
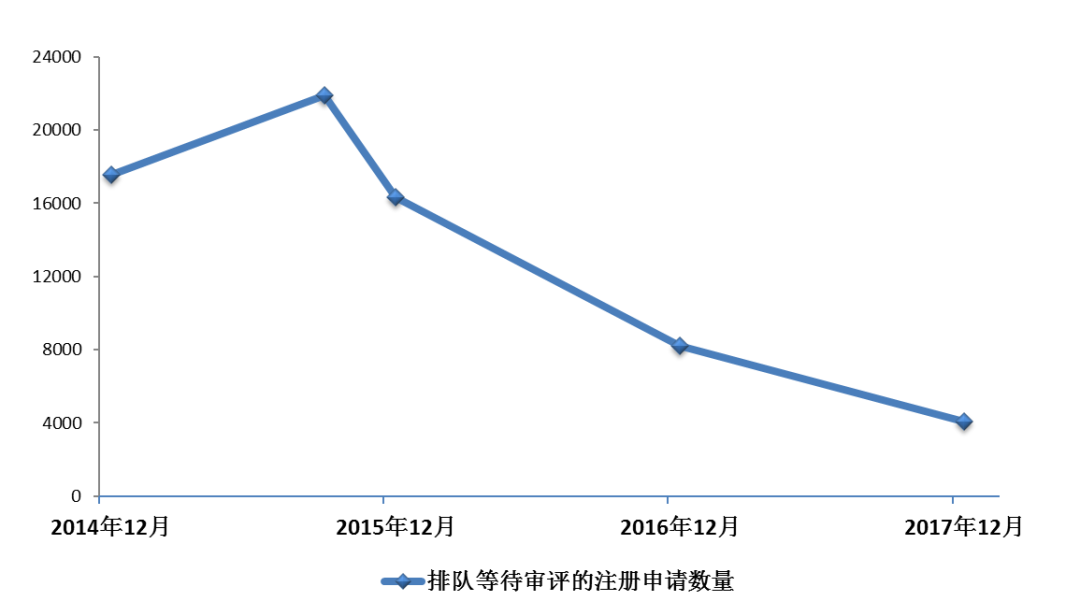
根據總局《關于調整部分藥品行政審批事項審批程序的決定》(局令第31號),在原有技術審評職能的基礎上,國家食品藥品監督管理總局藥品審評中心(以下簡稱藥審中心)承接藥物臨床試驗、藥品補充申請和進口再注冊3項行政審批決定職能。2017年,藥審中心完成審評審批的注冊申請共9680件(以受理號計,下同),其中完成審評的注冊申請8773件,完成直接行政審批(無需技術審評,下同)的注冊申請907件。排隊等待審評的注冊申請已由2015年9月高峰時的近22000件降至4000件(不含完成審評因申報資料缺陷等待申請人回復補充資料的注冊申請),中藥、化藥、生物制品各類注冊申請基本實現按法定時限審評審批,基本完成了國務院44號文件確定的解決藥品注冊申請積壓的工作目標。2014年-2017年排隊等待審評的注冊申請數量變化情況詳見圖1。
圖1 2014年-2017年排隊等待審評的注冊申請數量變化情況
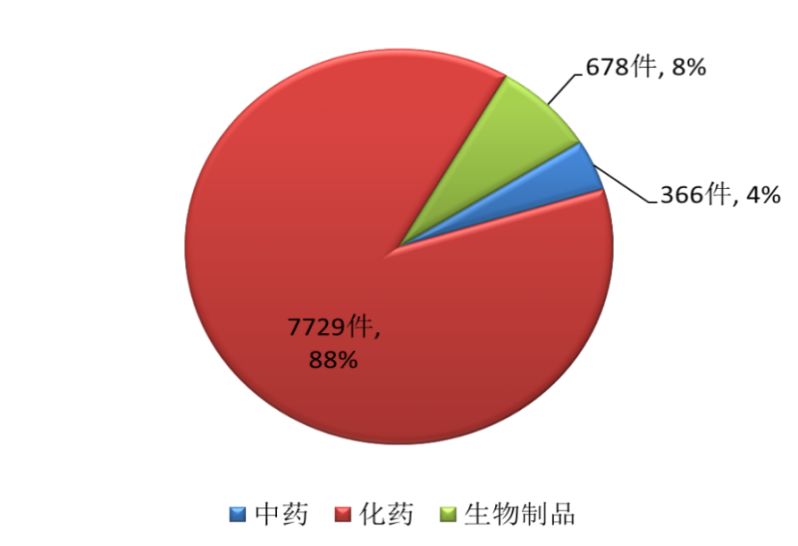
 完成審評的申請中,化藥注冊申請為7729件,約占全部審評完成量的88%。各類藥品注冊申請審評完成情況詳見圖2。
圖2 2017年各類藥品注冊申請審評完成情況
 3.各類注冊申請審評完成情況
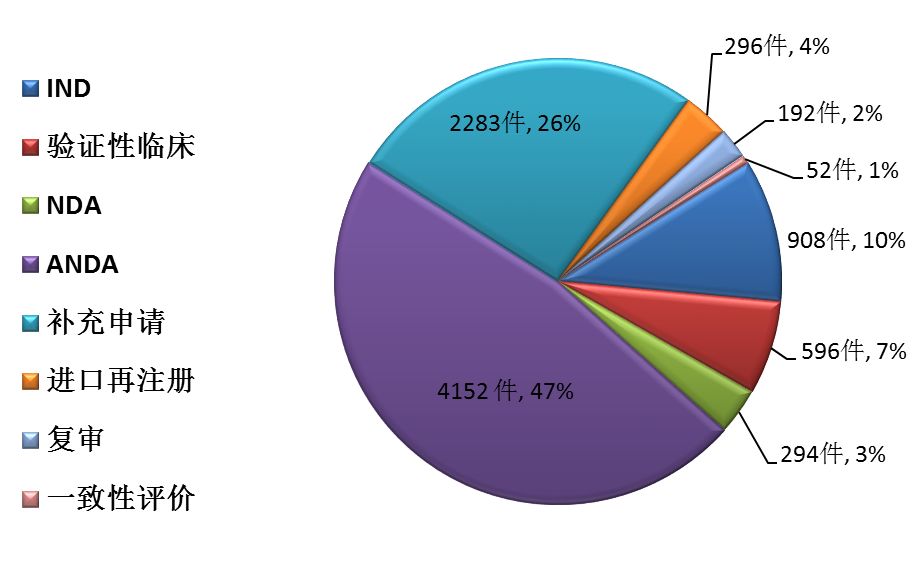
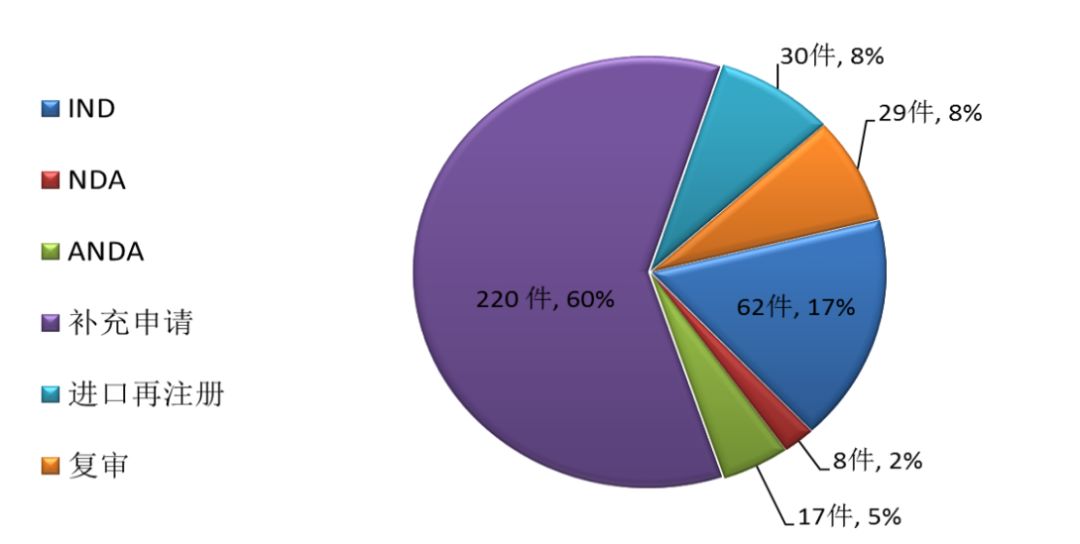
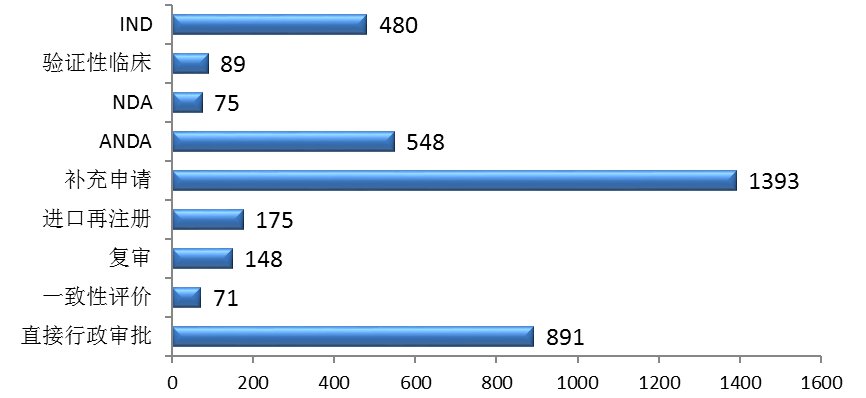
藥審中心完成新藥臨床試驗(IND)申請審評908件,完成新藥上市申請(NDA)審評294件,完成仿制藥上市申請(ANDA)審評4152件;審評通過批準IND申請744件(涉及373個品種),審評通過建議批準NDA 143件(涉及76個品種),審評通過建議批準ANDA 273件(涉及123個品種)。各類注冊申請審評完成情況詳見圖3。
圖3 2017年各類注冊申請審評完成情況
 注:化藥的品種數以活性成分統計,中藥和生物制品的品種數均以藥品通用名稱統計,下同。
(二)化藥注冊申請審評完成情況
1.總體情況
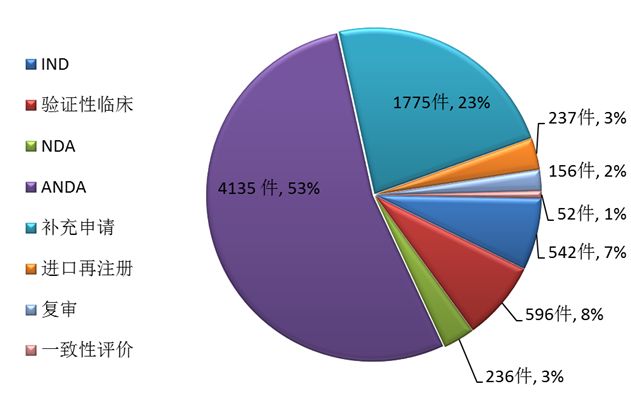
藥審中心完成審評的化藥注冊申請7729件,其中完成化藥ANDA 4135件,占化藥審評完成量的53%,基本解決了仿制藥注冊申請積壓的問題。完成審評的化藥各類注冊申請情況詳見圖4。
圖4 2017年完成審評的化藥各類注冊申請情況
 2.審評審批用時變化趨勢
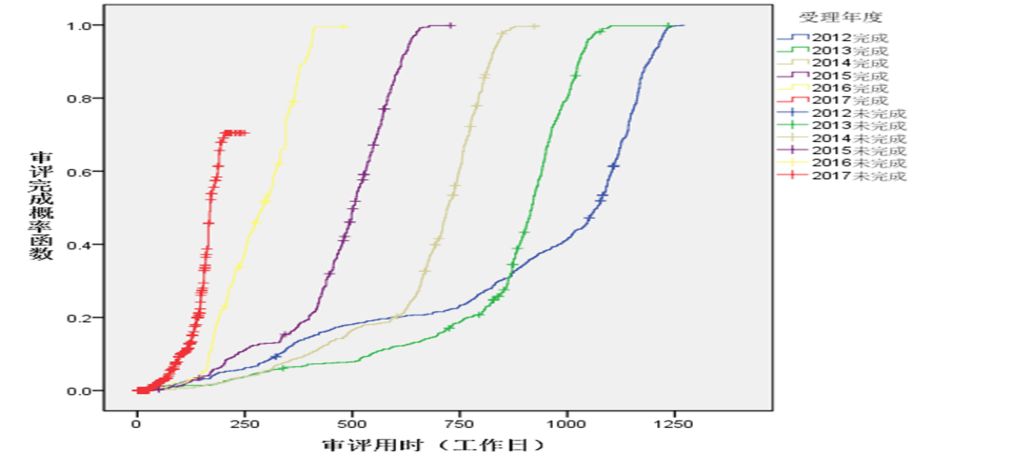
化藥各類注冊申請審評審批用時顯著下降,其中,仿制藥一致性評價(以下簡稱一致性評價)申請平均審評審批用時約為70個工作日,僅為法定時限的一半;IND申請首輪審評審批平均用時約為120個工作日,為法定時限的1.09倍,基本實現按法定時限審評審批。2012年-2017年各年度申報的IND申請、NDA、ANDA審評用時詳見圖5、圖6和圖7。
注:1. 一致性評價申請法定審評時限為120個工作日,審批時限為20個工作日,審評審批時限共計140個工作日;
2. IND申請法定審評時限為90個工作日,審批時限為20個工作日,審評審批時限共計110個工作日。
圖5 2012年-2017年各年度申報的IND申請審評用時
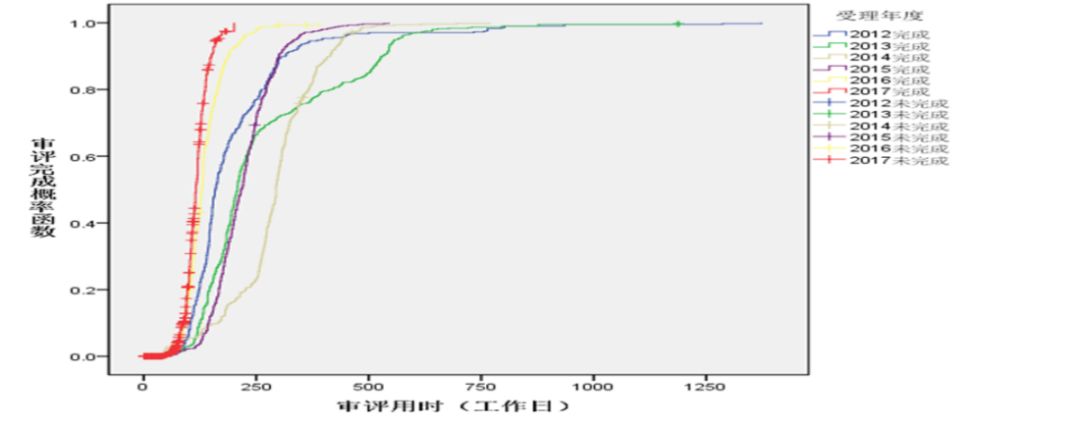 圖6 2012年-2017年各年度申報的NDA審評用時
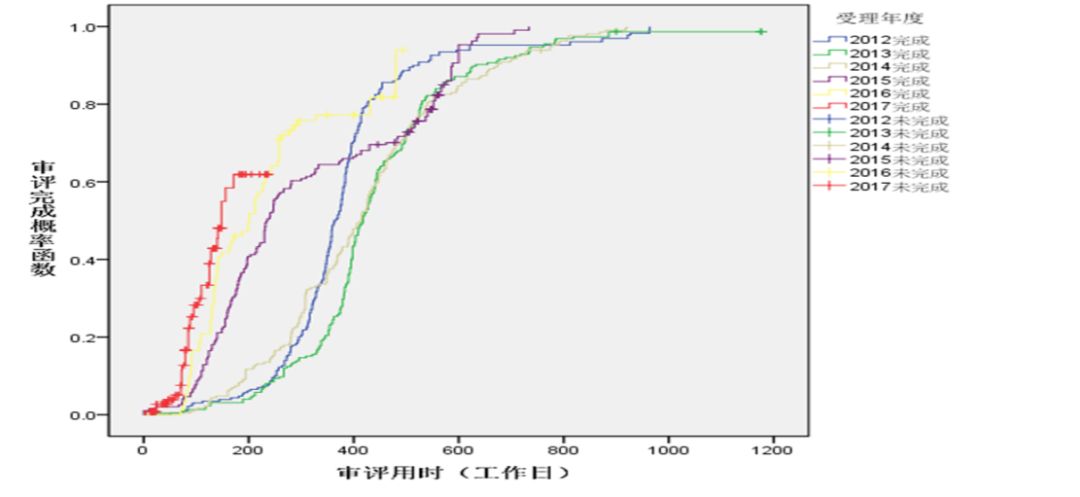 圖7 2012年-2017年各年度申報的ANDA審評用時
 3.審評建議批準的情況
藥審中心完成審評的化藥NDA 236件,其中審評通過建議批準上市113件。完成審評的化藥各類注冊申請批準情況詳見表1。
表1 2017年完成審評的化藥各類注冊申請批準情況
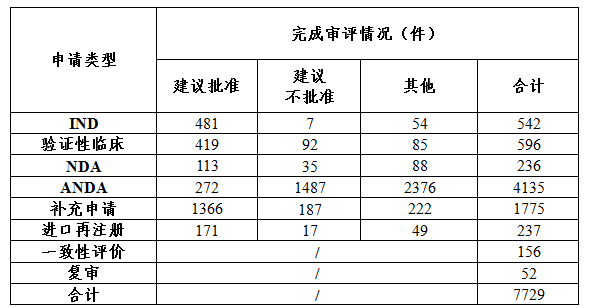 注:“其他”是指申請人主動申請撤回的注冊申請、完成審評等待申請人補充完善申報資料的注冊申請、非藥審中心審評報送總局藥化注冊司的注冊申請、送總局醫療器械審評中心的藥械組合注冊申請和關聯制劑撤回的原料/輔料注冊申請等,下同。
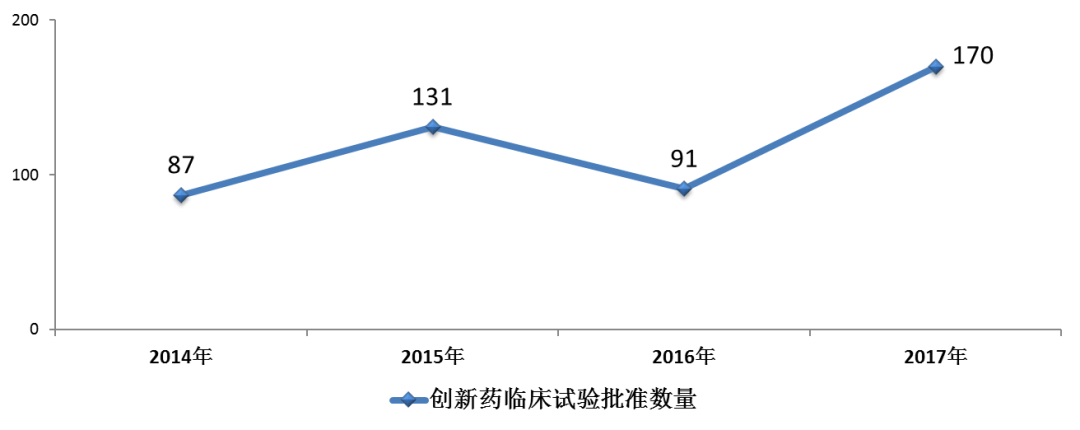
藥審中心完成審評的化藥IND申請542件,審評通過批準IND申請有481件,其中批準創新藥臨床試驗申請399件(共涉及170個品種),較2016年創新藥臨床試驗批準數量翻了一番。化藥創新藥臨床試驗批準數量與前三年比較(以品種計)詳見圖8。
圖8 2017年化藥創新藥臨床試驗批準數量與前三年比較(以品種計)
 注:化藥創新藥注冊申請是指按照《藥品注冊管理辦法》(原國家食品藥品監督管理局令28號)附件2的要求申報的化藥1.1類的注冊申請及按照總局《關于發布化學藥品注冊分類改革工作方案的公告》(2016年第51號)附件1要求申報的化藥1類的注冊申請,為境內外均未上市的全球新藥物,不包括改良新藥物;此次統計未納入進口原研藥臨床試驗申請及國際多中心臨床試驗申請,下同。
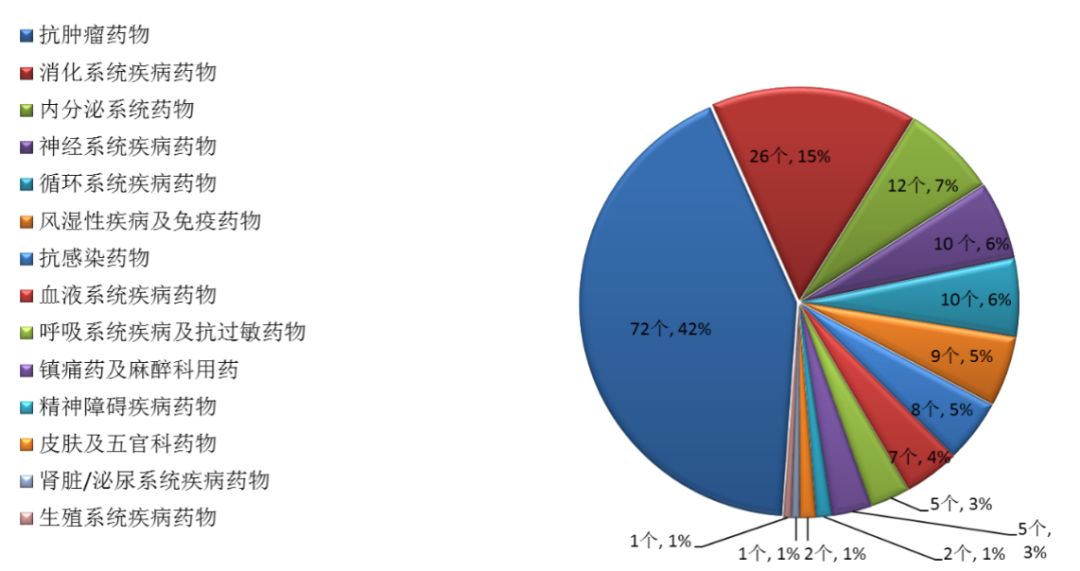
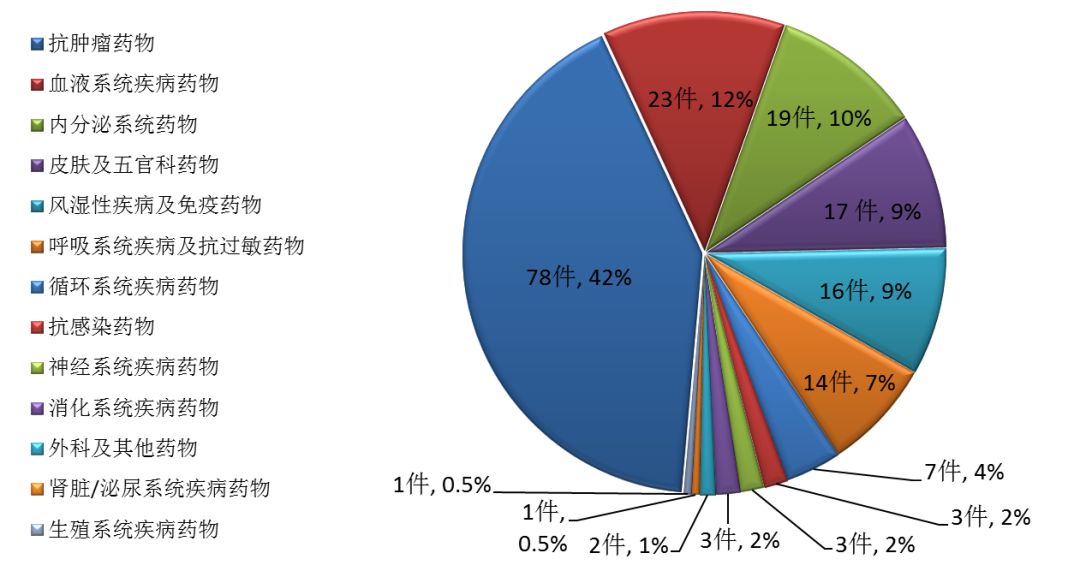
藥審中心審評通過批準創新藥臨床試驗170個品種中,抗腫瘤藥物、消化系統藥物和內分泌系統藥物較多,占全部創新藥臨床試驗批準數量的65%。批準臨床試驗的化藥創新藥適應癥分布(以品種計)詳見圖9。
圖9 2017年批準臨床試驗的化藥創新藥適應癥分布(以品種計)
 (三)中藥注冊申請審評完成情況
1.總體情況
藥審中心完成審評的中藥注冊申請366件,其中完成IND申請62件,完成NDA 8件,完成ANDA 17件。完成審評的中藥各類注冊申請情況詳見圖10。
圖10 2017年完成審評的中藥各類注冊申請情況
 2.審評建議批準的情況
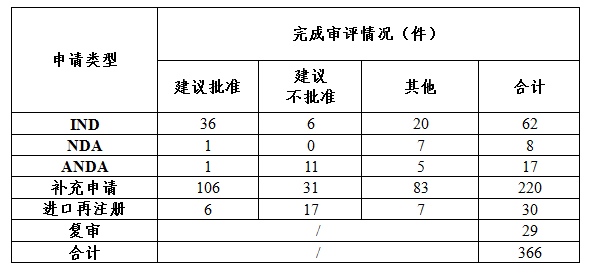
藥審中心審評通過批準中藥IND申請36件;審評通過建議批準中藥上市申請2件。完成審評的中藥各類注冊申請批準情況詳見表2。
表2 2017年完成審評的中藥各類注冊申請批準情況
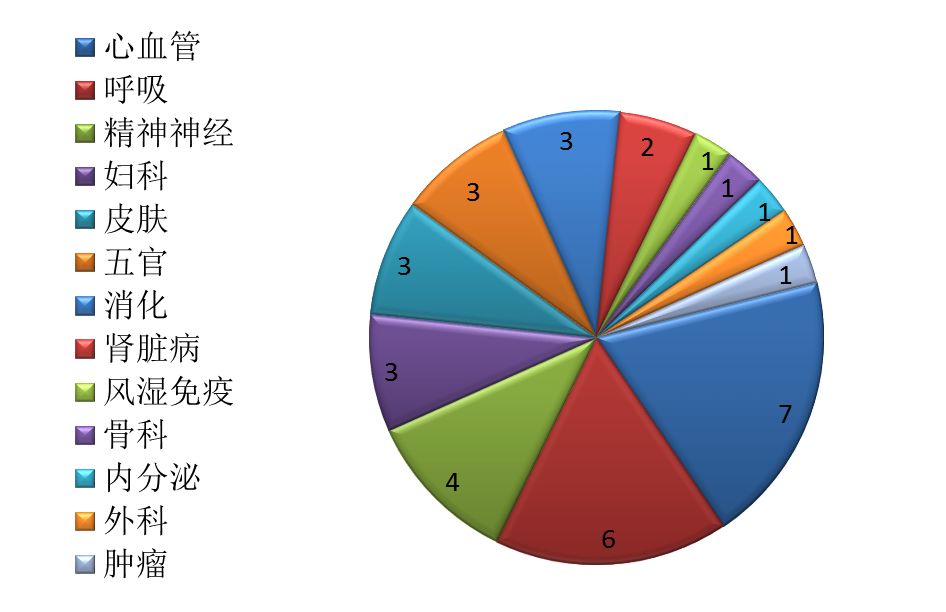
 藥審中心審評通過批準臨床試驗的中藥IND申請36件,涉及13個適應癥領域,其中心血管、呼吸、精神神經較多,共占47%,具體治療領域分布詳見圖11。
圖11 2017年批準臨床試驗的中藥適應癥分布
 (四)生物制品注冊申請審評完成情況
1.總體情況
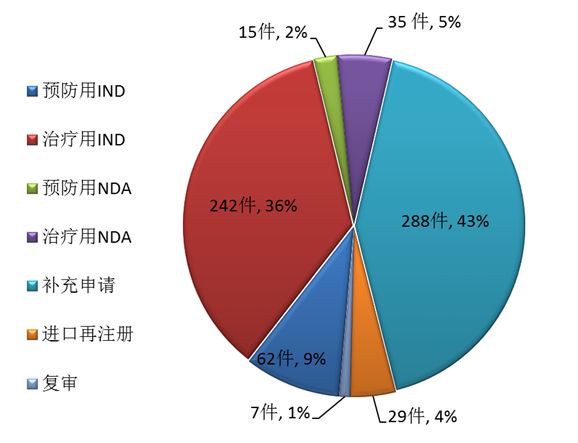
藥審中心完成審評的生物制品注冊申請共678件,其中完成預防用生物制品IND申請(預防用IND)62件,完成治療用生物制品IND申請(治療用IND)242件,完成預防用生物制品NDA(預防用NDA)15件,完成治療用生物制品NDA(治療用NDA)35件。完成審評的生物制品各類注冊申請情況詳見圖12。
圖12 2017年完成審評的生物制品各類注冊申請情況
 2.審評建議批準的情況
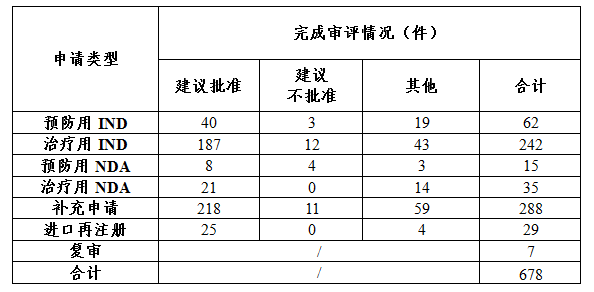
藥審中心審評通過批準預防用IND 40件,批準治療用IND 187件;審評通過建議批準預防用NDA 8件,建議批準治療用NDA 21件。完成審評的生物制品各類注冊申請批準情況詳見表3。
表3 2017年完成審評的生物制品各類注冊申請批準情況
 藥審中心審評通過批準生物制品IND申請227件,批準臨床試驗的治療用生物制品IND申請治療領域分布詳見圖13。
圖13 2017年批準臨床試驗的治療用生物制品適應癥分布
 二、藥品注冊申請受理情況
(一)總體受理情況
1.總體情況
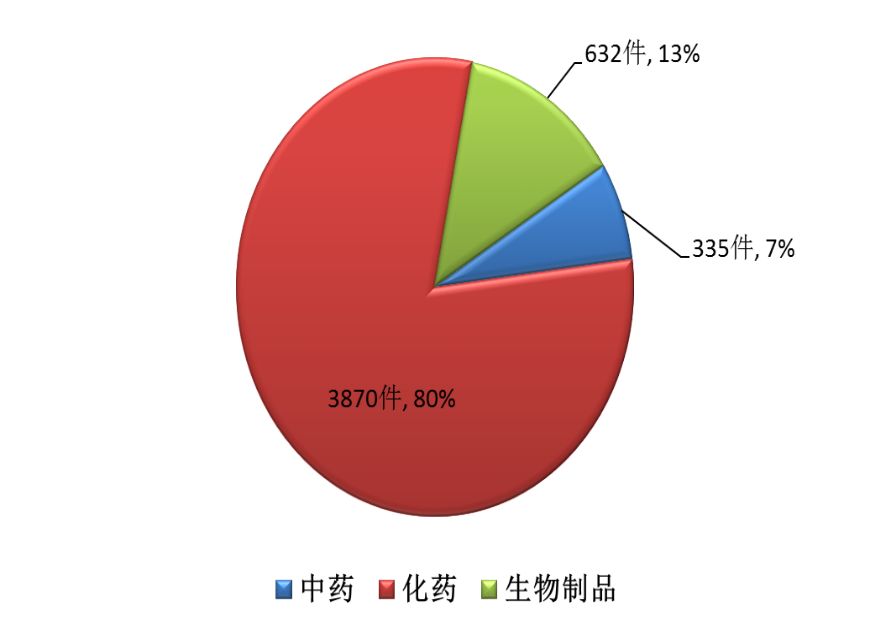
2017年,藥審中心接收新注冊申請共4837件,其中需審評的注冊申請3783件(含一致性評價注冊申請71件),直接行政審批的注冊申請1054件。化藥注冊申請受理量為3870件,占全部注冊申請受理量的80%,中藥和生物制品注冊申請分別為335件和632件。各類藥品注冊申請接收情況詳見圖14。
圖14 2017年各類藥品注冊申請接收情況
 2.國產創新藥受理情況
藥審中心接收國產1類創新藥注冊申請402件(涉及181個品種),其中接收臨床申請379件(涉及171個品種),上市申請23件(涉及10個品種)。按藥品類型統計,化藥324件(涉及112個品種),中藥2件(涉及1個品種),生物制品76件(涉及68個品種),創新藥的適應癥主要集中在抗腫瘤、抗感染領域。
3.進口藥受理情況
藥審中心接收進口藥新藥注冊申請259件(涉及133個品種),其中接收5.1類進口原研藥注冊申請117件(涉及70個品種),1類進口創新藥注冊申請75件(涉及37個品種),接收進口藥國際多中心臨床申請67件(涉及26個品種),創新藥的適應癥主要集中在抗腫瘤、抗感染領域。
(二)化藥注冊申請受理情況
1.總體情況
藥審中心接收化藥注冊申請共3870件,其中接收IND申請480件,接收NDA 75件,接收ANDA 548件。化藥各類注冊申請接收情況詳見圖15。
圖15 2017年化藥各類注冊申請接收情況
 2.創新藥受理情況
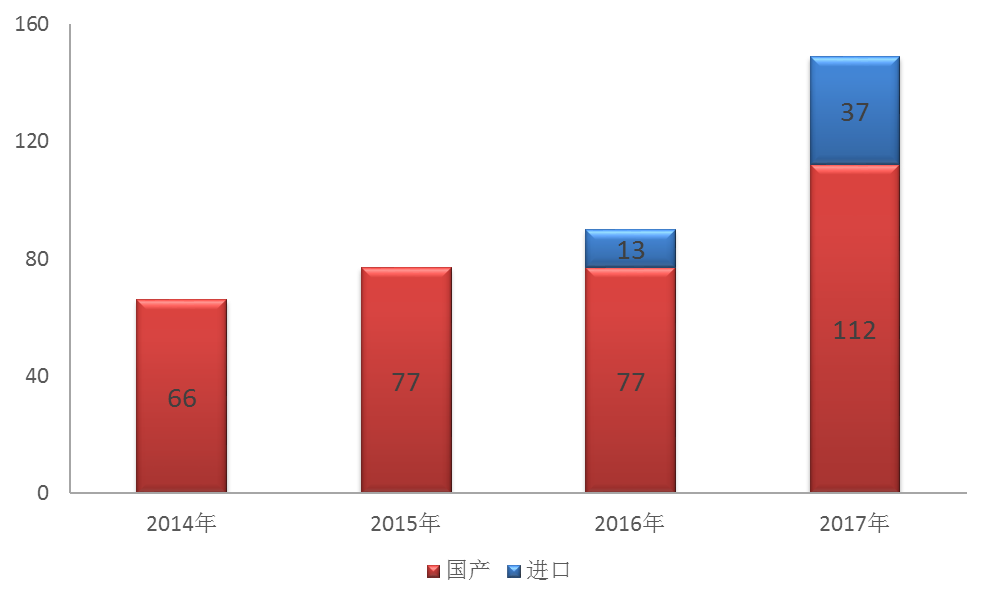
藥審中心接收化藥創新藥注冊申請149個品種,較2016年增長了66%,其中接收國產化藥創新藥注冊申請112個品種,進口創新藥注冊申請37個品種,2014年-2017年創新藥注冊申請接收情況詳見圖16。
圖16 2014年-2017年化藥創新藥注冊申請接收情況(以品種計)
 3.化藥新藥臨床試驗申請適應癥
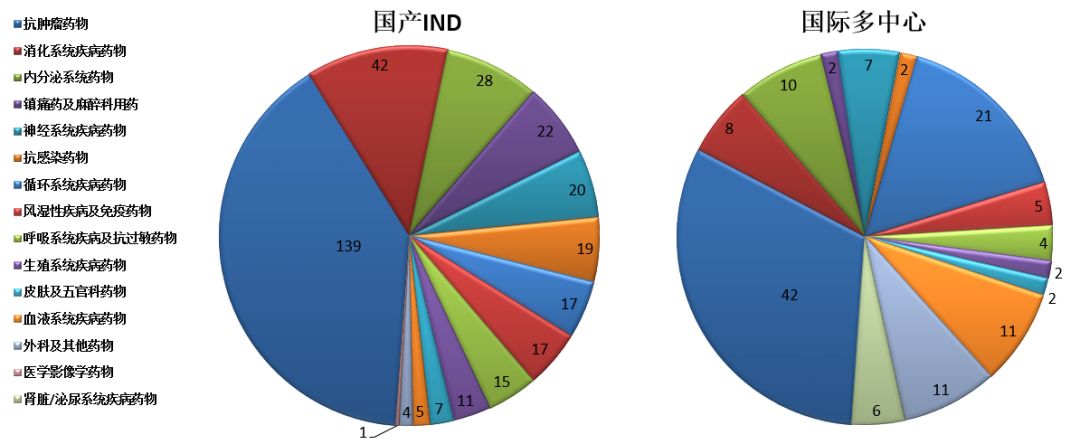
藥審中心接收化藥IND申請480件,其中接收國產化藥IND申請347件,接收國際多中心臨床試驗申請133件。國產化藥IND申請接收量較多的治療領域為抗腫瘤藥物、消化系統疾病藥物和內分泌系統藥物。國際多中心臨床試驗申請接收量較多的治療領域為抗腫瘤藥物、循環系統疾病藥物和血液系統疾病藥物,具體治療領域分布詳見圖17。
圖17 2017年接收的化藥IND申請治療領域分布情況
 (三)中藥注冊申請受理情況
藥審中心接收中藥注冊申請335件,其中接收中藥IND申請33件,接收中藥NDA 1件,接收中藥ANDA 7件。中藥各類注冊申請接收情況詳見圖18。
圖18 2017年中藥各類注冊申請接收情況
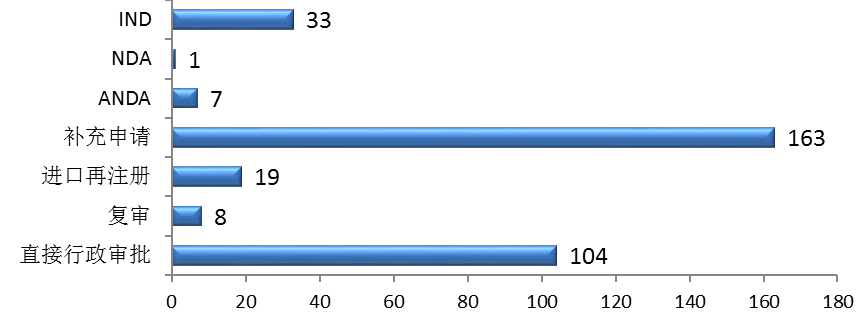 (四)生物制品注冊申請受理情況
藥審中心接收生物制品注冊申請632件,其中接收生物制品IND申請254件,接收生物制品NDA 50件。生物制品各類注冊申請接收情況詳見圖19。
圖19 2017年生物制品各類注冊申請接收情況
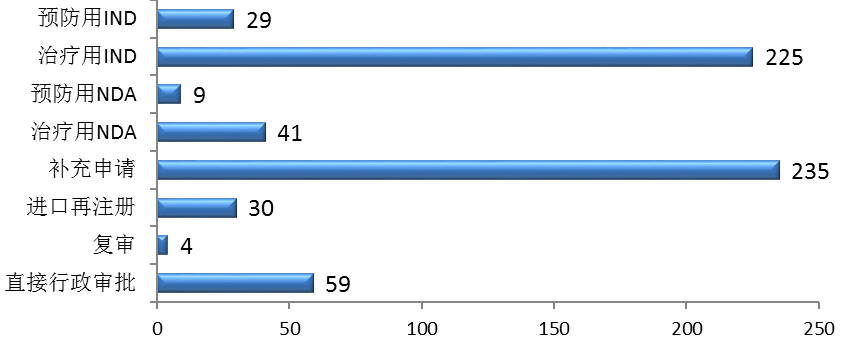 三、優先審評與溝通交流情況
(一)優先審評
1.優先審評品種納入情況
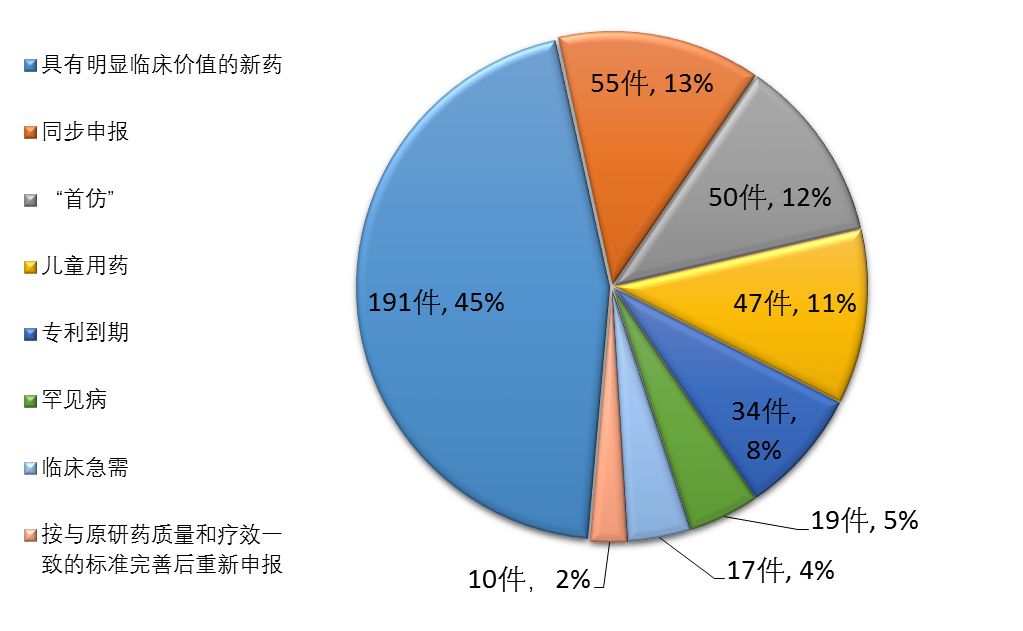
根據總局《關于解決藥品注冊申請積壓實行優先審評審批的意見》(食藥監藥化管〔2016〕19號),截至2017年底,藥審中心共將25批423件注冊申請納入優先審評程序,其中具有明顯臨床價值的新藥占比最大,共191件,占45%,兒童用藥共47件。納入優先審評程序的注冊申請情況詳見圖20。
圖20 納入優先審評程序的注冊申請情況
 2.優先審評品種審評完成情況
截至2017年底,納入優先審評程序的423件注冊申請中已有272件完成審評,占比為64%。自納入優先審評程序之日起,IND申請、NDA、ANDA首輪審評平均用時分別為39個工作日、59個工作日和81個工作日。
截至2017年底,共有110件注冊申請通過優先審評程序得以加快批準上市(以通用名計算,共涉及57個品種),其中,2017年有50個品種,具體品種名單詳見表4。包括國產自主研發的創新藥重組埃博拉病毒病疫苗、口服丙肝治療用新藥阿舒瑞韋軟膠囊、非小細胞肺癌靶向藥甲磺酸奧希替尼片、兒童抗癲癇用藥左乙拉西坦注射用濃溶液、治療乙肝和艾滋病的國產仿制藥富馬酸替諾福韋二吡呋酯膠囊等一批具有明顯臨床價值的藥品通過優先審評程序得以加快、優先批準上市,為滿足臨床用藥需求、降低用藥費用、促進公眾健康提供了有效保障。
表4 2017年完成審評建議批準上市的優先審評藥品名單
 (二)溝通交流情況
1.溝通交流總體情況
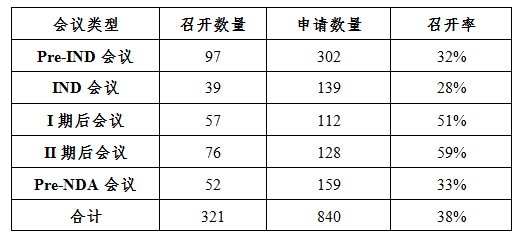
為進一步為申請人提供便利,提高溝通交流的質量和效率,藥審中心豐富了溝通交流渠道,形成了溝通交流會議、網絡平臺咨詢(一般性技術問題)、電話咨詢、郵件咨詢和周三現場咨詢的多渠道、多層次的溝通交流模式。2017年召開溝通交流會議321場,較2016年增長了172%;全年接收網絡平臺咨詢5881個,電話咨詢超過上萬次,郵件咨詢數千次,每周三定期開展現場咨詢。
2.溝通交流會召開情況
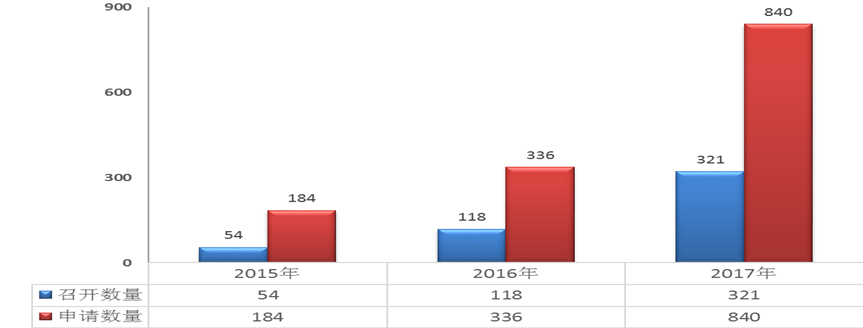
自總局《關于發布藥物研發與技術審評溝通交流管理辦法(試行)的通告》(2016年第94號)發布以來,藥審中心進一步加大了與申請人的溝通交流,截至2017年底,近3年共召開溝通交流會493場。2015年-2017年各類溝通交流會議召開情況詳見圖21。
圖21 2015年-2017年各類溝通交流會議召開情況
 藥審中心收到溝通交流會會議申請共840件,總體召開率為38%。其中Pre-IND會議和II期后會議召開數量較多,共召開173場,占全年溝通交流會議召開總量的54%。各類溝通交流會議召開情況詳見表5。
表5 2017年各類溝通交流會召開情況
 四、重要治療領域品種情況
2017年,一批具有明顯臨床價值的創新藥、臨床急需藥、專利到期藥和我國首仿藥通過技術審評建議批準上市。
抗腫瘤藥物:
1.甲磺酸奧希替尼片:為全球首個第三代晚期肺癌靶向藥,適用于既往經表皮生長因子受體(EGFR)酪氨酸激酶抑制劑(TKI)治療時或治療后出現疾病進展,并且經檢測確認存在EGFR T790M突變陽性的局部晚期或轉移性非小細胞性肺癌(NSCLC)成人患者的治療。肺癌是我國發病率和死亡率最高的惡性腫瘤,對于上述患者目前尚無有效的治療藥物,存在明確的臨床急需。該藥品針對上述患者具有較好的治療效果,安全性可以耐受,為上述特定的患者人群提供了新的治療選擇。
2.伊布替尼膠囊:為Bruton酪氨酸激酶(BTK)抑制劑,適用于治療既往至少接受過一種治療的套細胞淋巴瘤和慢性淋巴細胞白血病患者。該藥品是全球首個全新作用機制的治療慢性淋巴細胞白血病藥物,為慢性淋巴細胞白血病患者帶來更多的治療選擇。
3.維莫非尼片:為一種小分子BRAF絲氨酸-蘇氨酸激酶抑制劑,適用于治療BRAF V600突變陽性的不能切除或轉移性黑色素瘤。該藥品是全球首個治療惡性黑色素瘤的靶向藥物,可有效提高患者用藥的可及性。
4.磷酸蘆可替尼片:為小分子JAK1/JAK2激酶(Janus相關激酶)抑制劑,適用于治療中危或高危的骨髓纖維化。骨髓纖維化是罕見的骨髓增殖性腫瘤疾病,目前國內尚無明確有效治療手段,該藥品為全球首個用于治療骨髓纖維化藥物,可有效提高患者用藥的可及性。
抗感染藥物:
5.鹽酸達拉他韋片、6.阿舒瑞韋軟膠囊、7.西美瑞韋膠囊、8.索磷布韋片、9.奧比帕利片、10.達塞布韋片:為直接抗丙型肝炎病毒(HCV)藥物,適用于治療成人慢性丙型肝炎(CHC)。我國約有1000萬丙型肝炎患者,上述藥物批準上市有效解決了我國沒有直接抗病毒藥物的局面,為我國慢性丙肝患者提供了有效的突破性治療手段。
11.多替阿巴拉米片:為含有多替拉韋、阿巴卡韋和拉米夫定3種成分的新型抗人類免疫缺陷病毒(HIV)感染的固定劑量復方制劑,適用于治療成人和12歲及以上的青少年的HIV感染。目前治療艾滋病藥物有不良反應發生率高、耐受性差、藥物相互作用多等缺點,且長期服藥存在耐藥可能,該藥品較已上市的治療方案有一定的臨床優勢,為臨床增加新的治療選擇。
風濕性疾病及免疫藥物:
12.枸櫞酸托法替布片:為Janus激酶(包括JAK3)選擇性抑制劑,適用于治療對甲氨蝶呤療效不足或對其無法耐受的中度至重度活動性類風濕關節炎(RA)成年患者,可作為單藥治療,或者與甲氨蝶呤或其他非生物改善病情抗風濕藥(DMARD)聯合使用。該藥品是全球首個口服治療類風濕關節炎的靶向藥物,將為風濕關節炎患者帶來更多的治療選擇。
內分泌系統藥物:
13.達格列凈片:為高選擇性的人體腎臟鈉葡萄糖共轉運體(SGLT2)抑制劑,適用于II型糖尿病患者單藥治療。該藥品是全球首個全新作用機制的口服降糖藥物,可有效提高患者用藥的可及性。
循環系統藥物:
14.沙庫巴曲纈沙坦鈉片:為血管緊張素受體腦啡肽酶抑制劑,適用于治療伴有射血分數降低的慢性心臟衰竭患者(心功能Ⅱ-Ⅳ級),以降低心血管死亡和心力衰竭住院的風險。該藥品是近二十年來全球慢性心衰治療領域的突破性創新藥物,在減少心血管死亡、全因死亡、心衰住院(包括首次住院和全部住院),以及改善癥狀和患者報告結局方面,超過目前指南推薦的循證治療,可為臨床增加新的治療選擇。
皮膚五官藥物:
15.康柏西普眼用注射液:為國內首個適用于治療繼發于病理性近視的脈絡膜新生血管引起的視力損傷的生物制品藥物。由于城市化進程加快,用眼過度現象普遍存在,病理性近視引起的視力損傷并導致失明的發病人數呈上升趨勢,該藥品批準上市對有效提高此類病癥患者的臨床用藥可及性具有積極意義。
16.阿達木單抗注射液:為重組人免疫球蛋白(IgG1)單克隆抗體,新增適應癥適用于需要進行系統治療或光療、并且對其他系統治療(包括環孢素、甲氨蝶呤或光化學療法)不敏感、或具有禁忌癥、或不能耐受的成年中重度慢性斑塊狀銀屑病患者。該藥品為國內首個全人源的TNFα單抗,在抗藥抗體產生及安全性方面具有一定優勢,為臨床帶來一種更安全且有效的治療選擇。
神經系統藥物:
17.甲磺酸雷沙吉蘭片:為選擇性不可逆單胺氧化酶-B(MAO-B)抑制劑,適用于治療原發性帕金森病。該藥品在國外用于帕金森病早期的一線單藥治療,或與左旋多巴聯用治療中、重度帕金森病,可有效提高患者用藥的可及性。
消化系統藥物:
18.艾普拉唑腸溶片:為首個國產質子泵抑制劑創新藥,新增適應癥適用于治療反流性食管炎,為臨床提供更多有效治療選擇,增加了臨床可及性。
呼吸系統藥物:
19.丹龍口服液:為新的中藥復方制劑,適用于治療中醫熱哮證、支氣管哮喘患者。該藥品為我國上市許可持有人制度試點實施以來首個獲批的中藥新藥品種,為哮喘病患者提供一種全新的安全有效的治療方案,對提高患者的生存質量具有重要意義。
預防用生物制品(疫苗):
20.重組埃博拉病毒病疫苗(腺病毒載體):為我國自主研發的重組埃博拉疫苗,也是全球首個2014基因突變型埃博拉疫苗。藥審中心按照有條件批準程序完成了該疫苗上市申請的審評,該藥品對于應對埃博拉疫情的公共衛生需求和完成國家戰略儲備具有重大意義。
五、主要工作措施及進展情況
(一)審評審批制度改革縱深推進
一是在2016年確立的以臨床療效為審評工作導向的基礎上,以制度創新、流程再造為突破口,有破有立,逐步建立起以臨床價值為導向,以適應癥團隊審評模式為核心的科學審評工作體系,形成了由項目管理人制度、適應癥團隊審評制度、溝通交流制度、專家咨詢委員會與技術爭議解決制度、優先審評制度、審評信息公開制度等組成的審評制度體系,組建了38個專家咨詢委員會,建立起規范指導在前、溝通交流在中、審評決策在后的審評管理模式,加強審評環節的溝通和指導,申請人滿意度不斷提高。
二是審評體制機制問題逐步得到了改善。實現了兩個統一集中受理,9月實現仿制藥一致性評價的集中受理,12月實現總局審評審批、備案的注冊申請的集中受理,統一并規范了受理工作,解決了一直存在的受理與技術審評分離的問題。為推動審評審批一體化,5月1日起,藥審中心承接臨床試驗等3項行政審批決定職能,這極大地提高了審評審批的效率,又落實了審評人員的責任,提升了審評人員的責任意識。實行了原輔包與制劑共同審評審批的管理制度,逐步建立起以制劑為核心、原輔包為基礎的質量管理體系,藥品上市許可持有人承擔制劑質量主體責任的責任體系。
三是認真落實42號文件,積極推進改革臨床試驗管理,加快上市審評19項具體改革任務。建立了《中國上市藥品目錄集》制度,發布了首批納入目錄集的藥物;發布首批包含9個專利到期、終止、無效且尚無仿制藥申請的藥品品種清單;起草《拓展性同情使用臨床試驗用藥物管理辦法》《接受境外臨床試驗數據的技術要求》《急需藥品有條件批準上市的技術指南》《藥物臨床試驗風險控制管理辦法》《藥品注射劑基本技術要求》《關于調整藥物臨床試驗審評審批的公告》《化學原料藥、藥用輔料及藥包材共同審評審批管理辦法》,修訂《藥物研發與技術審評溝通交流管理辦法(試行)》,完善《藥品技術審評信息公開管理辦法》,進一步探索了專利鏈接、專利補償、數據保護等制度。此外,藥審中心還積極配合總局應對馬兜鈴酸、莎普愛思、匹多莫德、羧甲基淀粉鈉等緊急突發事件,探索并建立了應對突發事件的工作機制和處理流程。
(二)仿制藥一致性評價工作取得突破性進展
完成首批52件一致性評價申請的審評工作,其中通過一致性評價藥品共13個品種(17個品規)。8月藥審中心正式承接一致性評價整體工作以來,全面梳理一致性評價工作的受理、立卷審查、審評流程,調整審評系統,制定受理審查指南和立卷審查技術標準;建立專業審評依據,包括生物等效性以及臨床藥理學審評模板的構建,統計學審評要點和模板的進一步完善,以及國際、國內指導原則的歸類、整理和更新等。備案參比制劑6028條,其中289品種備案3141條,備案的企業數量695個。經詳細調研、企業確認、專家討論等,通過的164個參比制劑已分期分批向社會發布或即將發布。圓滿完成口服固體制劑已備案參比制劑的遴選工作。生物等效性研究(BE)備案和豁免研究方面,截至2017年底,一致性評價BE備案共計309條,其中289品種182條,共計124家企業,73個品種;非289品種127條,共計84家企業,77個品種。共提出基于科學性研究可豁免體內BE的品種82個(2批),首批推薦49個品種可豁免或簡化體內BE。此外,為保證一致性評價工作高效開展,在藥審中心網站還設立專欄集中公開相關公告,解答咨詢問題3000余個,并梳理形成共性咨詢問題解答,形成了《一致性評價百問百答》。
(三)ICH工作邁出堅實一步
2017年6月,總局成為國際人用藥品注冊技術協調會(ICH)成員,7月總局成立ICH工作辦公室并設在藥審中心。ICH工作辦公室本年度開展了一系列工作。一是密切保持對話與往來,促進雙方業務良好對接,就指導原則協調議題的處理、指導原則在中國的實施、轉化與培訓以及總局加入ICH管委會事宜等進行對話和磋商。二是派遣專家工作組(EWG)/執行工作組(IWG)專家36名參與國際指導原則的協調工作,11月代表團順利參與了ICH日內瓦大會及專家組會議,出色地完成了各項出訪任務,實現了預期工作目標,EWG專家在所在工作組的會議上的表現也獲得各方認可和積極評價。三是規范ICH指導原則議題的處理工作,制定相關工作程序,針對ICH正在協調的27個指導原則,組織主辦單位及外部協會成立了26個國內專家工作組,已組織處理的ICH指導原則協調議題共10個。四是深入研究指導原則在國內的轉化實施,并組織開展研討和培訓工作,不斷推進同國際標準接軌。
(四)審評科學基礎實現重點強化
一是加快審評質量體系建設。組建48人的質量管理內審員隊伍,制定《藥品審評質量管理規范(試行)》,首次實現了中藥、化藥、生物制品全品種全部通過ISO9001質量管理體系認證;按照世界衛生組織(WHO)監管能力提升要求,WHO 2019國家認證標準完成了上市許可和臨床試驗監管兩個模塊的首輪自評估。二是加強審評技術指導原則體系建設。起草技術指導原則53個,系統梳理國外監管機構技術指導原則515個;依托新機制、新模式,與中國中醫科學院西苑醫院合作完成5個中藥新藥臨床研究指導原則的制訂工作,全面梳理中藥技術指導原則和明確下一步制修訂清單,加快完善符合中藥特點的技術審評標準體系。三是加快審評信息化建設。建立藥品品種檔案登記平臺;建立原料藥、輔料、包材登記備案數據庫,為下一步實現藥物主控文件(DMF)制度奠定基礎;推進藥品電子通用技術文檔(eCTD)建設,初步完成我國eCTD申報流程設計,起草《藥品電子通用技術文檔結構》《化學仿制藥電子通用技術文檔申報指導原則》。
(五)人事制度改革持續發力
進一步優化內設組織機構,增設合規處、臨床試驗管理處、數據管理處和黨委辦公室(紀檢監察室)4個職能部門;多渠道持續引進人才,全年新進人員223人,引進首席科學家2人,針對部分高層次人才不愿意參加公開招聘的情況,首次探索采用直接選聘方式對某些緊缺崗位進行招聘;加強與外單位合作聯系,先后與山東省局、北京市局和浙江省局簽訂戰略合作協議,加大人員培訓力度,開展審評能力相關實踐培訓。
六、2018年重點工作安排
2017年,藥品審評工作取得了一定進展,但仍存在著一些問題:一是如何將鼓勵創新要求落到實處,建立符合國情的審評審批體系,需要深入思考研究;二是審評隊伍能力還不能完全適應新一輪全球科技革命、制藥產業創新發展和轉型升級的要求;三是由于歷史原因,已經批準上市的部分藥品中存在的療效或質量隱患尚未徹底解決,藥品全生命周期管理體系亟需建立。
2018年藥審中心將緊密圍繞總局工作部署,重點開展以下工作:
(一)落實重點工作部署,推動藥品高質量發展。2018年,藥審中心將加強統籌協調,提高緊迫感,加快落實各項改革任務。積極推動藥品注冊管理辦法修訂,逐步建立科學、符合實際的現代藥、傳統藥概念,以法治理念和要求指導藥品審評工作。研究啟動中藥注射劑再評價工作,制定再評價技術指導原則。不斷豐富藥品品種檔案,建立完善包括生產工藝、處方、原輔料包材、質量標準、說明書、上市后安全性信息、工藝變化等信息的數據庫。全力以赴做好一致性評價工作,對應開展而未開展評價工作的品種,提前研究退出機制和處理措施,把工作做在前面。實時更新《中國上市藥品目錄集》,做好批準上市品種和通過一致性評價品種的信息公開工作。
(二)繼續圍繞42號文件要求,不斷推進各項改革措施落地。推進前瞻性、先導性和探索性的重大前沿技術與審評工作的結合,激發制藥企業創新活力,促進制藥產業創新發展和轉型升級,加快新藥好藥上市,更好地滿足公眾臨床用藥需求。接受境外臨床試驗數據,優化臨床試驗審評審批程序,制定拓展性臨床試驗管理辦法,支持拓展性臨床試驗。加快上市審評,制定急需藥品有條件批準上市技術指導原則,修訂完善藥品注射劑基本技術要求,完善原料藥、藥用輔料和包裝材料共同審評審批管理程序。提升技術支撐能力,制定藥品審評項目管理辦法,完善藥品審評資料管理規范,加強藥品審評審批信息保密管理。
(三)加強基礎建設,推進藥品審評審批制度與國際接軌。加強國際合作,積極推進ICH相關工作。組織開展轉化實施二級指南的相關事宜,完善ICH工作辦公室的架構,建立符合ICH工作章程的相關工作制度,積極參與ICH國際協調和指導原則制定。繼續推進建立注冊申請受理、數據采集、評估、審評報告形成和審評過程管理的eCTD系統,盡早實現化學仿制藥按eCTD要求電子申報和審評。
(四)扎實推進審評體系和能力建設,加強人才隊伍建設和管理。繼續落實典型項目政府購買服務試點,積極推進新形勢下藥審中心組織體系建設,加快完善機構設置、專業設置、部門層級設置,提升藥品審評審批能力,建立完善現代化的藥品審評體系。根據審評工作的實際需要,進一步提高招聘精細化程度,探索高層次人才引進新渠道和新模式,不斷優化人才結構。加大人員培訓力度,設計分層次、有針對性的培訓體系;深入推進適應癥團隊建設,提高適應癥團隊工作的質量和效率。
雄關漫道真如鐵,而今邁步從頭越。藥審中心將堅定改革信心,不忘初心,牢記保護和促進公眾健康的使命,以更加開拓創新的膽識魄力,更加鍥而不舍的執著干勁,更加求真務實的工作作風,同心同德,真抓實干,加快建設具有國際影響力的、權威的、公眾信賴的審評機構,繼續譜寫藥品審評事業新篇章。
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|