
|
|
|||||
|
||||||
《2017年度醫(yī)療器械注冊工作報告》解析摘要:
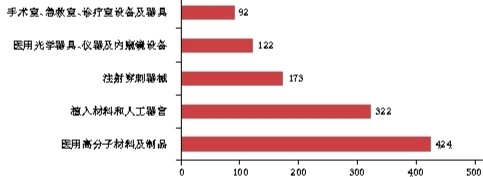 ▲境內第三類醫(yī)療器械注冊品種排位圖
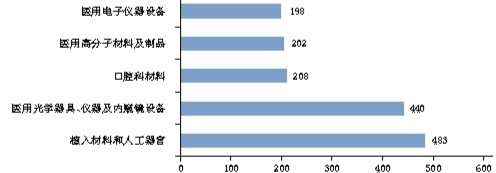 ▲進口醫(yī)療器械注冊品種排位圖
醫(yī)藥網4月3日訊 3月28日,《2017年度醫(yī)療器械注冊工作報告》(以下簡稱《報告》)發(fā)布,用翔實的內容和數(shù)據,全面展示和分析了2017年我國醫(yī)療器械注冊管理工作進展情況。《報告》顯示,2017年,我國醫(yī)療器械注冊管理法規(guī)體系不斷完善,醫(yī)療器械審評審批制度改革深入推進,境內醫(yī)療器械注冊增長明顯,產業(yè)自主創(chuàng)新意識增強。
法規(guī)標準逐步完善
2017年,國家醫(yī)療器械監(jiān)管部門配合完成《醫(yī)療器械監(jiān)督管理條例》修正案,發(fā)布了《醫(yī)療器械標準管理辦法》《體外診斷試劑注冊管理辦法修正案》《醫(yī)療器械臨床試驗機構條件和備案管理辦法》等法規(guī)文件。
《報告》就此指出,醫(yī)療器械注冊管理法規(guī)體系的逐步完善,為我國的醫(yī)療器械注冊管理工作提供了制度保障;同時也為醫(yī)療器械企業(yè)注冊申報工作的有序開展提供了良好的法規(guī)基礎。
醫(yī)療器械標準是醫(yī)療器械研制、生產、經營、使用和監(jiān)督管理遵循的統(tǒng)一技術要求,是醫(yī)療器械產業(yè)發(fā)展水平的重要標志。2017年,國家醫(yī)療器械監(jiān)管部門修訂發(fā)布《醫(yī)療器械標準制修訂工作管理規(guī)范》,細化了標準制修訂工作程序;組織開展86項醫(yī)療器械行業(yè)標準制修訂工作,審核發(fā)布《醫(yī)療器械 質量管理體系 用于法規(guī)的要求》等98項醫(yī)療器械行業(yè)標準。
科學合理的醫(yī)療器械分類是醫(yī)療器械全過程監(jiān)管的重要基礎。2017年,國家醫(yī)療器械監(jiān)管部門組織成立了醫(yī)療器械分類技術委員會,發(fā)布了新《醫(yī)療器械分類目錄》,并積極開展了宣貫、培訓工作;完成過敏原類、流式細胞儀配套用、免疫組化和原位雜交類體外診斷試劑產品的屬性及類別調整工作,合理降低有關產品類別,滿足臨床使用需求。
產品創(chuàng)新步伐加快
2017年,國家醫(yī)療器械監(jiān)管部門全力推進醫(yī)療器械審評審批制度改革工作。特別是去年10月,中辦、國辦《關于深化審評審批制度改革鼓勵藥品醫(yī)療器械創(chuàng)新的意見》(以下簡稱《意見》)發(fā)布后,改革步伐進一步加快。
在完善審評機制,優(yōu)化審評流程方面,先后發(fā)布了《醫(yī)療器械審評溝通交流管理辦法(試行)》《關于發(fā)布醫(yī)療器械技術審評專家咨詢委員會管理辦法的公告》《關于調整部分醫(yī)療器械行政審批事項審批程序的決定》;發(fā)布第三批免于進行臨床試驗醫(yī)療器械目錄,對164種醫(yī)療器械豁免臨床試驗,減輕了行政相對人負擔。
在《意見》激勵下,國內醫(yī)療器械創(chuàng)新產品注冊申請呈風起云涌之勢。2017年,國家醫(yī)療器械監(jiān)管部門共收到創(chuàng)新醫(yī)療器械特別審批申請273項,最終批準12個創(chuàng)新產品注冊上市, 比2016年增加了2個產品。此外,還批準遼寧垠藝生物科技股份有限公司生產的藥物洗脫球囊導管、武漢華大智造科技有限公司生產的基因測序儀、無錫市申瑞生物制品有限公司生產的尿中游離巰基檢測試劑盒(生化法)等部分有較好臨床應用前景的醫(yī)療器械產品注冊。
境內器械注冊增長明顯
醫(yī)療器械臨床試驗是保證器械產品安全性和有效性的重要舉措。《報告》顯示,2017年醫(yī)療器械臨床試驗監(jiān)督抽查力度不斷加大,全年組織2批醫(yī)療器械臨床試驗監(jiān)督檢查,共抽取19家企業(yè)的19個注冊申請項目,對涉及的38家臨床試驗機構進行檢查,對3個存在真實性問題的注冊申請作出不予注冊、自不予注冊之日起1年內不予再次受理的處理決定,有力地凈化了醫(yī)療器械臨床試驗環(huán)境。其間,共有169家企業(yè)主動撤回261項醫(yī)療器械注冊申請。
此外,針對國內醫(yī)療器械發(fā)展實際,國家醫(yī)療器械監(jiān)管部門還發(fā)布實施了《醫(yī)療器械網絡安全注冊技術審查指導原則》《移動醫(yī)療器械注冊技術審查指導原則》《醫(yī)療器械注冊單元劃分指導原則》,并發(fā)布了人工耳蝸植入系統(tǒng)、醫(yī)用磁共振成像系統(tǒng)、髖關節(jié)假體系統(tǒng)等80項醫(yī)療器械注冊技術審查指導原則,有效統(tǒng)一了相關審查要求,對規(guī)范指導相關產業(yè)健康發(fā)展意義重大。
臨床試驗和審查要求的不斷規(guī)范,助推了境內器械的發(fā)展壯大。從《報告》中的數(shù)據可以看出,與2016年相比,2017年批準的境內第二類、第三類醫(yī)療器械注冊數(shù)量均有明顯增長。其中,批準境內第三類醫(yī)療器械注冊3300項(醫(yī)療器械1910項,體外診斷試劑1390項),比2016年增加了13.7%;批準進口醫(yī)療器械5623項(進口第二類醫(yī)療器械注冊2823項,進口第三類醫(yī)療器械注冊2800項),同比減少2.3%。值得關注的是,在批準注冊的境內第三類醫(yī)療器械中,注冊數(shù)量排在首位的醫(yī)用高分子材料及制品,其注冊數(shù)量與2016年相比,增長高達56.5%。
與此同時,境內第二類醫(yī)療器械注冊數(shù)量也在顯著增長。去年各省級食品藥品監(jiān)管部門共批準境內第二類醫(yī)療器械注冊18582項,比2016年增長了19.5%。
|
|
Copyright ?2015 廣東穗康醫(yī)藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯(lián)系我們
|