
|
|
|||||
|
||||||
大批獲歐美批文藥品,報一致性評價摘要:
醫藥網6月19日訊 日前,CDE公布的《擬納入優先審評程序藥品注冊申請的公示(第二十九批)》名單引起了業界關注,名單中有12個藥品是先在美國或歐盟上市,再回到國內進行申報的。根據《CFDA關于仿制藥質量和療效一致性評價工作有關事項的公告(2017年第100號)》的相關規定,這些藥品的申請在國內獲批后,可視為通過一致性評價。不難看出,繼華海藥業的纈沙坦片后,越來越多企業正試圖通過出口轉內銷的方式實現一致性評價的彎道超車。
有統計數據指出,截至目前國內上市藥企中擁有較多國外獲批產品的排頭方陣包括了華海藥業、石藥集團、海正藥業、恒瑞醫藥等,前三家藥企目前已有一批產品通過了一致性評價,如何利用好政策紅利,把這些已在國外獲批的產品的效益推向更高呢?
華海藥業
據華海藥業2017年年報數據,該公司有48個制劑產品自主擁有美國ANDA文號。2018年上半年,坎地沙坦酯氫氯噻嗪片、吡格列酮片、利格列汀片(暫時批準)、氯吡格雷片、非布司他片(暫時批準)陸續獲得了FDA的ANDA批準文號,公司擁有的ANDA產品數量上升至50個以上。
利格列汀片與非布司他片的ANDA為暫時批準,因需要等在專利權到期后并得到FDA最終批準,才能獲得在美國市場銷售的資格。
表1:目前華海藥業通過一致性評價產品情況
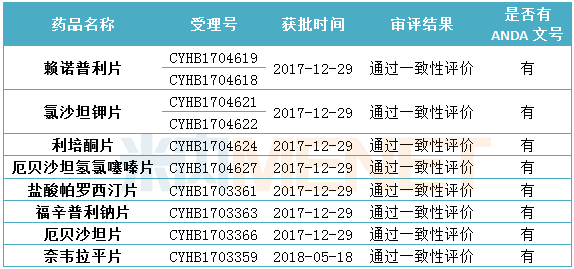 (米內網MED2.0數據庫,統計截至2018.6.15)
表2:華海藥業目前在審批中的仿制藥申請(僅統計新注冊分類)
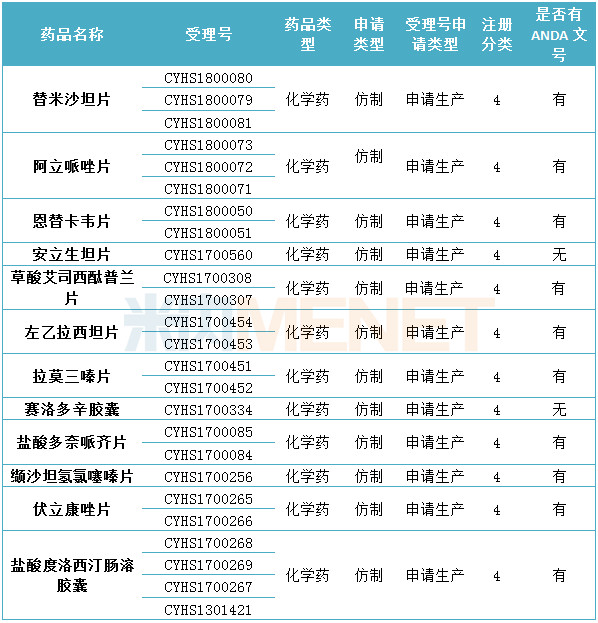 (米內網MED2.0數據庫,統計截至2018.6.15)
據米內網MED2.0數據庫數據顯示,截至目前,華海藥業通過一致性評價的產品共有8個,均已在國外獲批。目前華海藥業在申請化學藥4類仿制藥生產的產品中,有10個產品已在國外獲批。
石藥集團
據石藥集團年報中提到,截至2016年該公司已申報ANDA的藥品共計7個,2017年又取得了8個藥品的ANDA注冊批準,該公司目前獲得ANDA的產品數量超過15個。接下來還有5個待批ANDA的藥品,包括鹽酸美金剛片、普瑞巴林膠囊及鹽酸度洛西汀緩釋膠囊等。
表3:石藥集團目前已通過一致性評價的產品情況
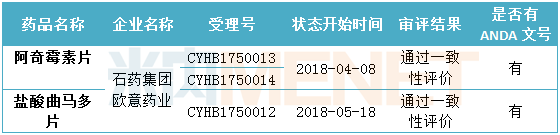 (米內網MED2.0數據庫,統計截至2018.6.15)
表4:石藥集團目前在審批中的仿制藥申請(僅統計新注冊分類)
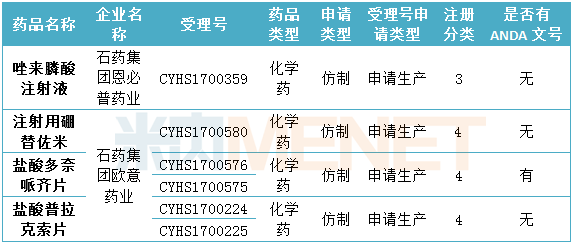 (米內網MED2.0數據庫,統計截至2018.6.15)
截至目前,石藥集團通過一致性評價的產品共有2個,均在國外獲批。6月4日,石藥集團發布公告,稱按化學藥品新注冊分類報批的注射用紫杉醇(白蛋白結合型)已被納入《中國上市藥品目錄集》。按照相關規定,直接納入《中國上市藥品目錄集》及可以使用“通過一致性評價”標識表示該藥品與原研藥質量和療效一致,可實現原研藥的臨床替代。目前石藥集團在申請化學藥4類仿制藥生產的產品中,有1個產品在國外獲批。
海正藥業
米內網翻閱海正藥業的公告,粗略統計截至2018年5月底,獲得ANDA的藥品也超過了5個,其中包括了辛伐他汀片、嗎替麥考酚酯膠囊、二甲雙胍緩釋片等多個重點產品。
表5:海正藥業目前已通過一致性評價的產品情況
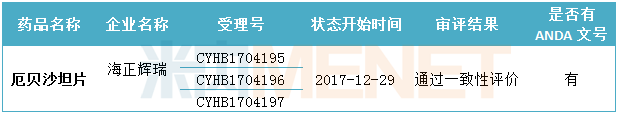 (米內網MED2.0數據庫,統計截至2018.6.15)
表6:海正藥業目前在審批中的仿制藥申請(僅統計新注冊分類)
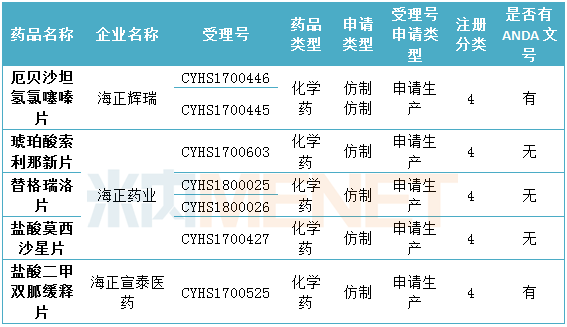 (米內網MED2.0數據庫,統計截至2018.6.15)
截至目前,海正藥業通過一致性評價的產品有1個,已在國外獲批。目前海正藥業在申請化學藥4類仿制藥生產的產品中,有2個產品已在在國外獲批。
恒瑞醫藥會否緊跟其后?
從目前來看,華海藥業、石藥集團、海正藥業通過了一致性評價的產品均已在國外獲批,并且在審批中的產品也有不少是已在國外獲批的產品。日前公布的第二十九批擬優先審評審批名單中,華海藥業的恩替卡韋片、替米沙坦片、阿立哌唑片,以及石藥集團的鹽酸多奈哌齊片,海正藥業的厄貝沙坦氫氯噻嗪片,獲得擬優先審評審批的理由為“同一條生產線生產,且已在美國上市”。
表7:目前恒瑞醫藥ANDA產品情況
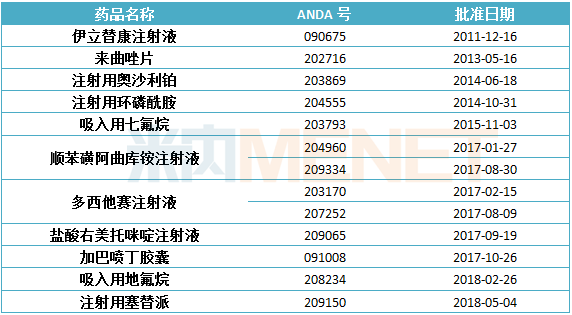 (根據網絡資料整理)
相關政策:
《CFDA關于仿制藥質量和療效一致性評價工作有關事項的公告(2017年第100號)》中提到,支持中國境內企業生產的在歐盟、美國或日本批準上市的藥品在中國上市。
1、在歐盟、美國或日本批準上市的仿制藥已在中國上市并采用同一生產線同一處方工藝生產的,申請人需提交境外上市申報的生物等效性研究、藥學研究數據等技術資料,由國家食品藥品監督管理總局審評通過后,視同通過一致性評價。
2、在歐盟、美國或日本批準上市的仿制藥已在中國上市但采用不同生產線或處方工藝不一致的,企業需按一致性評價的要求,以境外上市申報的處方工藝和生物等效性研究、藥學研究數據等技術資料向國家食品藥品監督管理總局遞交變更申請,審評通過后,批準變更處方工藝,視同通過一致性評價。
3、在歐盟、美國或日本上市但未在中國境內上市的,經臨床研究證實無種族差異的,可使用境外上市申報的生物等效性研究、藥學研究數據等技術資料向國家食品藥品監督管理總局提出上市申請;可能存在種族差異的,應開展相應的臨床試驗。審評通過的視同通過一致性評價。
如有錯漏,歡迎指正
來源:米內網數據庫、新財富、西南證券等
|
|
Copyright ?2015 廣東穗康醫藥有限公司
粵ICP備15022662號(粵)
-技術支持:信息管理部|聯系我們
|