
|
|
|||||
|
||||||
6月份18款新藥在中美歐獲批上市摘要:
醫(yī)藥網(wǎng)7月19日訊 相關(guān)統(tǒng)計(jì)顯示,6月份,共有18款新藥在中國(guó)、美國(guó)和歐盟獲批上市,中國(guó)批準(zhǔn)的新藥數(shù)量首次超過(guò)美國(guó)和歐盟(詳見(jiàn)表)。
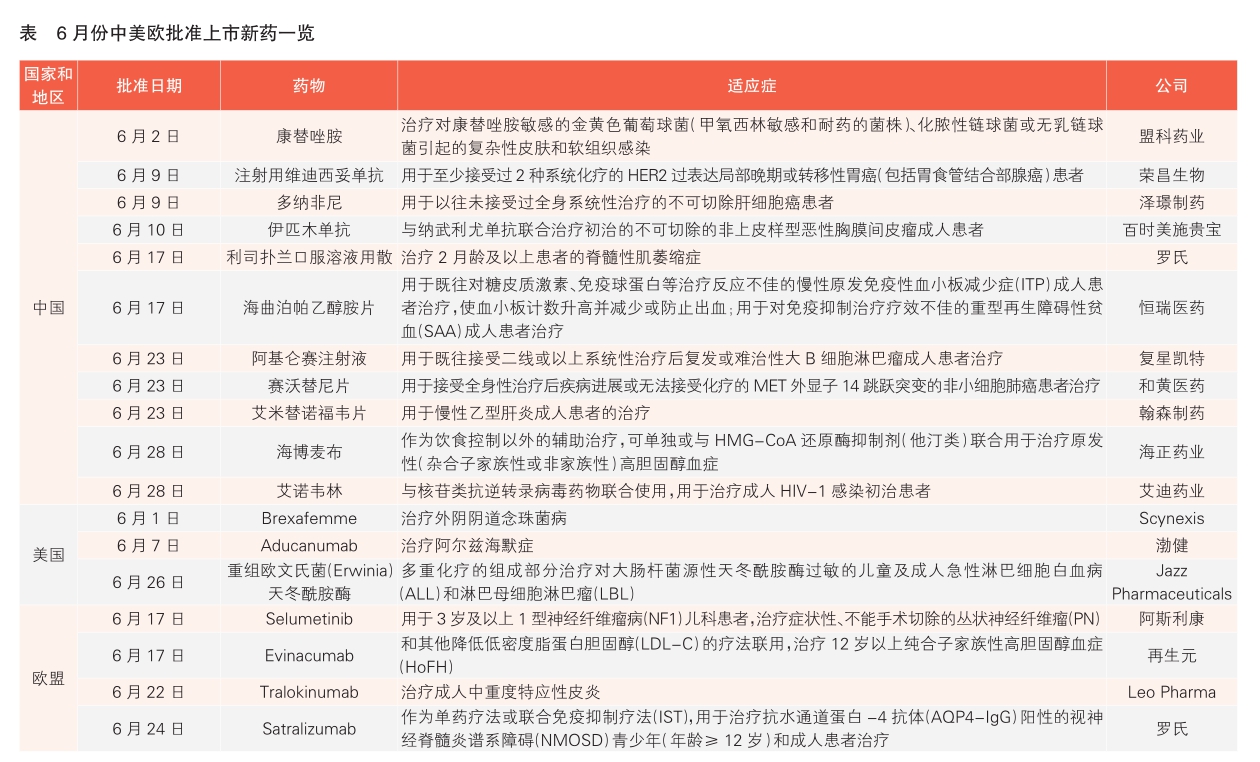 中國(guó)批準(zhǔn)11款新藥上市
6月份中國(guó)批準(zhǔn)了11款新藥上市,其中8款為中國(guó)藥企自主研發(fā)的新藥。
盟科藥業(yè)、榮昌生物、澤璟制藥、復(fù)星凱特、海正藥業(yè)、艾迪藥業(yè)6家企業(yè)在6月都迎來(lái)了公司首個(gè)新藥獲批上市。
作為一款口服噁唑烷酮類(lèi)抗菌藥,康泰唑胺獲批是基于一項(xiàng)治療復(fù)雜性皮膚及軟組織感染(cSSTI)的關(guān)鍵性Ⅲ期臨床研究。589例復(fù)雜性皮膚及軟組織感染患者接受了口服康泰唑胺800mg或利奈唑胺600mg治療,結(jié)果表明,康泰唑胺在主要終點(diǎn)治愈檢驗(yàn)期(TOC,最后一次給藥后的7~14 天)的臨床治愈率,非劣效于利奈唑胺,并顯示了更低的藥物相關(guān)的血液學(xué)不良事件。
注射用維迪西妥單抗(RC48)是抗HER2單抗-MMAE偶聯(lián)劑,也是首款上市的中國(guó)公司自主研發(fā)的抗體偶聯(lián)藥物(ADC)。其獲批上市是基于一項(xiàng)單臂、開(kāi)放、多中心的Ⅱ期關(guān)鍵性臨床試驗(yàn)結(jié)果。研究共入組127例既往接受過(guò)二線或二線以上系統(tǒng)化療的HER2過(guò)表達(dá)(包括IHC3+、IHC2+/FISH+及IHC2+/FISH-病人)晚期胃癌(包括胃食管結(jié)合部腺癌)患者。研究數(shù)據(jù)表明,RC48客觀緩解率(ORR)達(dá)24.4%,PFS(無(wú)進(jìn)展生存時(shí)間)為4.1個(gè)月,OS(總生存期)達(dá)7.6個(gè)月。
多納非尼是索拉非尼的氘代產(chǎn)品,也是第一個(gè)能與索拉非尼在肝細(xì)胞癌一線治療頭對(duì)頭試驗(yàn)中獲得成功的小分子藥物。在未接受過(guò)系統(tǒng)治療的不可手術(shù)或轉(zhuǎn)移性晚期肝細(xì)胞癌患者中,相對(duì)于現(xiàn)有索拉非尼,多納非尼具有更好的療效和安全性,能夠顯著延長(zhǎng)晚期肝癌患者的總生存期;在部分亞組人群中,多納非尼生存期超過(guò)21個(gè)月。
阿基侖賽注射液是復(fù)星凱特于2017年從吉利德科學(xué)旗下凱特公司引進(jìn)Yescarta(Axicabtagene Ciloleucel)技術(shù)并獲授權(quán)在中國(guó)進(jìn)行本地化生產(chǎn)的靶向CD19自體CAR-T細(xì)胞治療產(chǎn)品。該藥目前公布的售價(jià)為120萬(wàn)元/袋。
海博麥布片是與依折麥布同靶點(diǎn),通過(guò)抑制甾醇載體Niemann-Pick C1-like1(NPC1L1)依賴(lài)的膽固醇吸收,從而減少小腸中膽固醇向肝臟轉(zhuǎn)運(yùn),降低血液膽固醇水平,和肝臟膽固醇貯量。該藥可作為單藥服用或與他汀類(lèi)藥物聯(lián)用,為原發(fā)性高膽固醇血癥患者提供了新的治療選擇。
艾諾韋林是非核苷類(lèi)逆轉(zhuǎn)錄酶抑制劑,可通過(guò)非競(jìng)爭(zhēng)性結(jié)合并抑制HI V逆轉(zhuǎn)錄酶活性,從而阻止病毒轉(zhuǎn)錄和復(fù)制。艾諾韋林的Ⅲ期臨床試驗(yàn)結(jié)果顯示,其抗病毒有效性與對(duì)照組的依非韋倫相當(dāng),可快速降低患者體內(nèi)病毒載量,對(duì)高、低基線病毒載量抑制均有效且療效持續(xù)穩(wěn)定。
美國(guó)批準(zhǔn)3款新藥上市
今年6月,美國(guó)批準(zhǔn)3款新藥上市。根據(jù)Pharmadigger醫(yī)藥數(shù)據(jù)庫(kù)顯示,這3個(gè)產(chǎn)品均為全球首次批準(zhǔn)上市,也均通過(guò)加速批準(zhǔn)通道獲批。
Brexafemme是20多年來(lái)首個(gè)獲批的創(chuàng)新型抗真菌藥物,也是首個(gè)治療陰道酵母菌感染的非唑類(lèi)療法。值得一提的是,豪森藥業(yè)已與Scynexis簽訂戰(zhàn)略合作協(xié)議,獲得在大中華區(qū)開(kāi)發(fā)和商業(yè)化Brexafemme的獨(dú)家權(quán)益。美國(guó)FDA曾授予Brexafemme合格傳染病產(chǎn)品資格(QIDP)、快速通道資格以及孤兒藥認(rèn)定,并且上市申請(qǐng)獲得了優(yōu)先審評(píng)。
Br exaf emme的獲批基于兩項(xiàng)Ⅲ期臨床研究的積極結(jié)果。研究結(jié)果表明,每日口服一次該藥,在外陰陰道念珠菌病(VVC)患者中表現(xiàn)出顯著的療效和良好的耐受性。治療10天后,63.3%的患者達(dá)到臨床治愈的主要終點(diǎn),58.5%的患者達(dá)到真菌學(xué)根除的次要終點(diǎn),72.3%的患者獲得了臨床改善。
Aducanumab是FDA自2003年以來(lái)首次批準(zhǔn)的阿爾茲海默病(AD)治療藥物,也是首款FDA批準(zhǔn)的靶向AD潛在發(fā)病機(jī)制的藥物。批準(zhǔn)基于兩個(gè)Ⅲ期臨床試驗(yàn)的結(jié)果,顯示出Aducanumab對(duì)降低β-淀粉樣蛋白有劑量和時(shí)間依賴(lài)性。從安全性看,Aducanumab也有不可忽視的不良反應(yīng),在兩個(gè)Ⅲ期臨床試驗(yàn)中,大約有40%的患者出現(xiàn)了腦腫脹。該藥雖然成功獲批但也引起爭(zhēng)議不斷。該藥獲批是通過(guò)FDA的“加速批準(zhǔn)”計(jì)劃,F(xiàn)DA批準(zhǔn)的一個(gè)條件是渤健必須進(jìn)行上市后試驗(yàn),以確認(rèn)該藥物可以改善認(rèn)知。渤健有9年的時(shí)間來(lái)完成試驗(yàn),如果藥物不能達(dá)到預(yù)期療效,將采取措施將其從市場(chǎng)上撤回。
天冬酰胺酶的重要作用是從循環(huán)血漿中代謝天冬酰胺。天冬酰胺是一種天然存在的氨基酸,也是癌細(xì)胞存活和增殖所必需的。重組歐文氏菌(Erwinia)天冬酰胺酶的成功獲批,是通過(guò)“實(shí)時(shí)腫瘤審評(píng)(Real-Time Oncology Review,RTOR)”程序進(jìn)行的,RTOR相比優(yōu)先審評(píng)所需時(shí)間更短(其于2019年10月獲FDA授予快速通道資格)。該藥同時(shí)在今年6月還獲得FDA授予治療急性淋巴細(xì)胞白血病(ALL)或淋巴母細(xì)胞淋巴瘤(LBL)的孤兒藥認(rèn)定。
歐盟批準(zhǔn)4款新藥
6月份,歐盟批準(zhǔn)了4款新藥,其中Tralokinumab是首次全球獲批上市,其余均已在美國(guó)獲批上市。
Evinacumab是首個(gè)阻斷血管生成素樣蛋白3(ANGPTL3)功能的靶向療法,批準(zhǔn)基于一項(xiàng)Ⅲ期臨床試驗(yàn)。試驗(yàn)結(jié)果顯示,患者在接受治療24周以后,治療組與對(duì)照組相比,低密度脂蛋白膽固醇(LDL-C)水平降低49%(p<0.0001)。患者在接受治療后2周內(nèi)LDL-C就開(kāi)始出現(xiàn)降低,而且在為期24周的臨床試驗(yàn)和為期48周的開(kāi)放標(biāo)簽擴(kuò)展試驗(yàn)中得到維持。
Satralizumab是歐盟首個(gè)也是唯一一個(gè)同時(shí)可用于成人和青少年(≥12歲)治療AQP4-IgG血清陽(yáng)性神經(jīng)脊髓炎(NMOSD)的藥物,該藥已于2020年在美國(guó)和日本上市。
Tralokinumab是全球首個(gè)獲批治療特應(yīng)性皮炎的單克隆抗體療法。批準(zhǔn)基于與糖皮質(zhì)激素聯(lián)用的Ⅲ期臨床試驗(yàn)結(jié)果。16周時(shí),Tralokinumab組實(shí)現(xiàn)皮損幾乎清除或幾乎完全清除的患者比例為38.9%,安慰劑組為26.2%。
|
|
友情鏈接
Copyright ?2015 廣東穗康醫(yī)藥有限公司
粵ICP備15022662號(hào)(粵)
-技術(shù)支持:信息管理部|聯(lián)系我們
|